Сергиев П. Новая жизнь сломанных клеток, или как работает аутофагия
Исследование процесса аутофагии — очень интересная и, более того, модная сейчас тема. Относительно фундаментальных процессов, происходящих в клетке, аутофагия была открыта недавно. Её «идея» заключается в переработке мусора из крупных клеточных структур, которые ломаются в нашем организме. Чтобы в дальнейшем клетка могла использовать их для синтеза требующихся ей компонентов, эти структуры необходимо разобрать на составные части.
У аутофагии — две задачи. Первая: разборка на части «сломанных» органелл, вторая — восполнение ресурсов при голодании. Если мы говорим про вторую задачу аутофагии, то зачастую происходит переработка не сломанных органелл, а тех, которые в данный момент не нужны клетке. В таком случае ими можно пожертвовать для создания более важных элементов.
В процессе эволюции человеческому о рганизму не хватало ресурсов. Наши предки нередко были вынуждены голодать, и аутофагия была «оптимизирована» так, чтобы можно было не тратить энергию на менее важные жизненные процессы. Например, если органелла продолжает функционировать, но при этом работает неэффективно, то организм с целью экономии не тратит энергию на её разбор.
Известно, что ограничение числа калорий способствует увеличению продолжительности жизни. В современном мире при наличии проблемы переедания, когда калории, накапливающиеся в организме, некуда девать, хочется найти им применение. Можно предположить, что избыточные калории получится пустить
на обновление внутриклеточных органелл. При этом интересно, что аутофагия активируется при недостатке белка. Разборка внутриклеточных органелл способствует выработке аминокислот, а это вдвойне полезно для организма.
Ещё одним плюсом аутофагии служит то, что происходит процесс разбора накапливающихся в нервных клетках белковых агрегатов, которые могут вызывать нейродегенеративные заболевания, такие как болезнь Паркинсона. В компонентах системы аутофагии происходят мутации, которые вызывают это заболевание. Есть шанс, что, «подстегнув» аутофагию, мы сможем лечить такого рода заболевания более простыми способами.
В клетках регулярно накапливаются повреждения, такой процесс в нашем организме происходит постоянно. Если говорить о его причинах, то можно выделить две основные.
Первая заключается в том, что митохондрии по общепринятой теории повреждаются из-за продуцирования активных форм кислорода (АФК). Несмотря на то, что у митохондрий существуют механизмы защиты от повреждений, при большом кол ичестве АФ К прои сходит «окисл итель- ный стресс» — это ключевой фактор в деструктивных изменениях митохондрий.
Вторая причина — обыкновенные ошибки в работе молекулярных машин. Так, процесс создания дочерних молекул ДНК, который называется репликацией, может вызывать мутации.
Но как узнать, хорошо ли в клетке работает аутофагия? В первую очередь, мы получаем информацию о клеточном процессе благодаря сенсорам, которые его регулируют. Основным из них служит mTOR-киназа. Это белок, который регу
лируется доступностью аминокислот и энергии. Он получает информацию изнутри и извне клетки. Так остальные клетки сообщают с помощью инсулиноподобного фактора роста о том, что организму хватает ресурсов. Если mTOR-киназа активна, клетка понимает, что ресурсов достаточно и нет необходимости в аутофагии, но если белок mTOR подавлен, клетка не получает сигнал о наполненности ресурсами и ау- тофагия запускается.
Когда происходит включение аутофагии, образуется мембранная структура, которая называется омегасомой, или фагофором. Внешне она напоминает ковш. Эта конструкция захватывает ор- ганеллы, которые требуется поглотить и переварить. Фагофор замыкается вокруг собранных органелл, после чего мембранная аутофагосома, в которую превратился фагофор, сливается с лизо- сомой, отвечающей за процесс переваривания сломанных частиц. В лизосоме находятся пищеварительные ферменты, способствующие тщательному разбору испорченных органелл.
Другой вопрос — как клетка узнаёт о том, какие элементы повреждены. На поверхности фагофора прикреплены белки-рецепторы, которые через адапторные белки узнают повреждённые органеллы, например неработающие митохондрии. Мы можем смотреть на состояние белков-адаптеров, которые располагаются на фагофоре. Они имеют название LC3. У нас есть возможность увидеть, во-первых, их кругооборот в клетке, во-вторых, их преобразования, которые происходят при присоединении к мембранной струк- туре-фагофору, а в-третьих, их попадание в лизосому.
Следить за этими процессами можно с помощью молекулярно-биологических методов. К ним относится иммуноблотинг, идентифицирующий антигены с помощью гелей и сывороток, и флюоресцентная микроскопия. Всё это помогает наблюдать за происходящими в клетках процессами, в том числе и за аутофагией.
Активные формы кислорода (АФК) — соединения кислорода с высокой реакционной способностью. Будучи агрессивными окислителями, они легко повреждают клеточные белки, липиды и другие биомолекулы. Один из главных источников АФК — энергетический обмен веществ в митохондриях. Добывая энергию для клетки, митохондрии используют кислород, и АФК образуются как побочный продукт этих реакций. Поскольку АФК появляются в митохондриях, то митохондрии и страдают от них одними из первых. В норме клетка держит АФК под контролем с помощью специальныханти- оксидантных ферментов. Но,так или иначе, окислительные повреждения всё равно постепенно накапливаются, вынуждая клетку время от времени избавляться от вышедших из строя органелл и молекул, которые могут быть потенциально опасными.
Киназами называют фосфорилирующие ферменты: они присоединяют остатки фосфорной кислоты к другим белкам и тем самым сильно меняют их активность. mTOR — одна из самых «влиятельных» киназ: работая в составе крупных молекулярных комплексов, она регулирует активность белков, от которых зависит клеточный рост и деление, подвижность клеток, адаптацию к стрессам и т. д. В то же время сама киназа mTOR ловит различные молекулярные сигналы о том, какие ресурсы есть внутри клетки и в её окружении. К таким сигналам относят белки из группы факторов роста, стимулирующие деление клеток. Считается, что подавляя работу mTOR, можно предотвратить самые разные хронические заболевания, вплоть до онкологических и нейро- дегенеративных, таких как болезнь Паркинсона и болезнь Альцгеймера.
Но помимо того, чтобы следить за клеточными процессами, не менее интересно научиться ими управлять, найти вещества, запускающие процесс аутофагии. В ходе нашего исследования были выдвинуты две идеи их поиска. Первая — достаточно тривиальная. Мы решили искать активаторы аутофагии в химических библиотеках, в библиотеках синтезированных веществ.
Вторая идея заключается в том, что активаторы могут находиться в микробиоте. Считается, что в каждом из нас бактериальных клеток больше, чем клеток нашего организма. В кишечнике человека несколько килограммов микробиоты. Взаимодействие с микробиотой для нас взаимовыгодное, симбиотическое. Мы даём пищу микробам, они же, в свою очередь, дают нам много веществ, необходимых для организма. Непатогенные микробы синтезируют то, что человек не может выработать самостоятельно, например, часть аминокислот и витамины. У нас возникла мысль: некоторые животные долгое время голодают, например, медведи и летучие мыши, проводящие несколько месяцев в спячке, или верблюды, которые могут обходиться без пищи продолжительный срок. Нам стало интересно, могут ли эти животные «подбирать» свою микробиоту так, чтобы им было проще переживать периоды голодания?
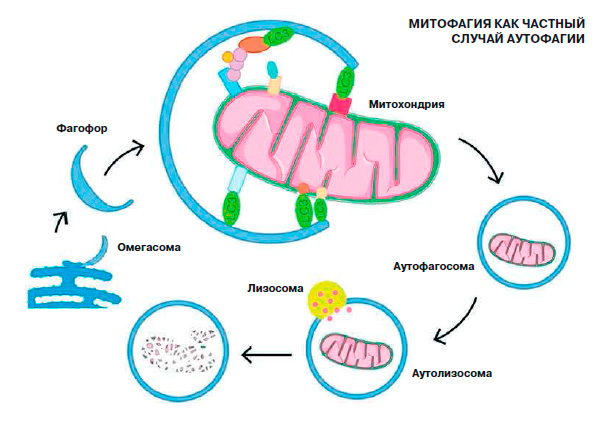
Когда клетка чувствует, что ей надо заняться аутофагией, к эндоплазматической сети, или эндоплазматическому ретикулуму, приходят соответствующие молекулярные сигналы. Эндоплазматическая сеть представляет собой сложный обширный лабиринт из мембран — на каком-то участке этих мембран вырастает омегасома, мембранная органелла с особым липидным составом и специальными белками. Омегасома формирует фагофор — ковшеобразную структуру, которая существует уже независимо от эндоплазматической сети. Фагофор несёт на себе белки LC3 — они помогают ему узнать испорченные митохондрии и другие клеточные органеллы, подлежащие утилизации. (Кроме LC3 тут задействованы и другие белки, участвующие в простых и сложных цепочках сигналов.) Фагофор, поймавший митохондрию, превращается в аутофагосому. С аутофагосомой соединяется лизосома — мембранный пузырёк с расщепляющими ферментами внутри. Аутофагосома становится аутолизосомой и «переваривает» ненужную митохондрию.
Кстати, сбор микробиоты — это один из самых интересных этапов в исследовании. В основном мы с коллегами работаем в лабораториях, однако для добычи микробиоты пришлось организовать миниэкспедицию.
Весной я поехал в Астрахань, где договорился с верблюдоводческим хозяйством, чтобы посетить верблюдов. Там мы познакомились с весьма тощими представителями этого вида с висящими горбами и собрали у них нужную нам микробиоту.
А насчёт медведей я договорился с Центрально-Лесным заповедником в Тверской области. После того, как медведи выходят из спячки, они покидают берлоги, предварительно оставив фекалии в своей пещере. Сотрудники помогли нам собрать этот биологический материал, именно из него и была потом выделена микробиота.
После всего этого наши коллеги из Пущино, которые занимаются анаэробными микроорганизмами, наращивали собранную микробиоту на разных питательных средах. И уже из этой питательной среды мы выделяли экстракты и тестировали на клетках. Искать активаторы аутофагии можно не только у животных, но и среди лекарственных растений. Направление оказалось весьма продуктивным, я бы даже сказал самым продуктивным.
На данный момент мы находимся в процессе поиска лекарственных растений, которые не только не навредят, но и помогут стимулировать аутофагию. Это исследование происходит совместно с одной коммерческой компанией. После того, как мы завершим этап выявления активаторов аутофагии среди трав и растений, будем пробовать создать на их основе биологические добавки.
Параллельно мы тестируем найденные соединения на модели болезни Паркинсона у рыб. Есть идея создать помимо пищевых добавок лекарственные препараты, которые позволят активно бороться с ней- родегенеративными заболеваниями.
Получится или нет вылечить болезнь Паркинсона, мы не можем сказать с уверенностью, не достигнув финального результата. То, что аутофагия способна помочь при нейродегенеративных заболеваниях, это довольно известный факт. Вопрос в том, насколько сильным будет терапевтический эффект от тех соединений, которые мы найдём. Но дорогу осилит идущий!
Изначально мы тестируем все выявленные соединения на клеточных линиях, так как объём материала очень большой и опробовать всё на животных практически невозможно. После обнаружения перспективных соединений мы продолжаем исследование на рыбах. Происходит ещё один этап «отсева». Оставшиеся вещества, самые успешные и безопасные, тестируем на мышах. В настоящее время этот этап только начинается.
Мы создали модели мышек с нокаутом гена лептина для тестирования ожирения. Лептин — это белок, который синтезирует жировая ткань. Чем больше жировая ткань, тем больше лептина вырабатывается в нашем организме. Если этот белок будет в избытке, то он даст мозгу понять, что стоит прекратить потреблять пищу в больших количествах. При отключении этого гена такой сигнал не поступает, мышь постоянно кушает и со временем становится похожа по форме на шар.
Ген обратно включить нельзя, но наша цель состоит в проверке активаторов аутофагии. Может быть, они позволят этой мышке сбросить вес несмотря на то, что у неё выключен ген лептина.
Сейчас у нас продолжается этап скрининга. Впереди исследование ещё 15 000 химических соединений. Помимо этого, проводится идентификация активных соединений из микробиоты и лекарственных растений. Пока найдено буквально несколько веществ, но мы стремимся к большему количеству. На данном этапе нельзя сказать, что мы вышли на конечный продукт, но нам известно уже несколько активаторов аутофагии, что, несомненно, радует.
Пётр СЕРГИЕВ, доктор химических наук, директор Научно-исследовательского института физико-химической биологии им. А. Н. Белозерского






 Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий
Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий





