Болдырева Е. Физическая фармация и ее возможности
Создание новых эффективных лекарств — долгий и трудоемкий процесс. Он требует многолетних усилий не только ученых, но и инженеров, в том числе специалистов по физической фармации, опирающейся в значительной степени на достижения химии твердого тела, физической химии, кристаллографии.
В конце 2011 г. журнал Американского химического общества «Chemistry and Engineering News» вынес на обложку вопрос: «Вам нужны вещества или лекарства?». Вопрос закономерный, потому что синтезированные искусственно или же извлеченные из природного сырья и существующие в виде «просто» порошков или жидкостей лекарственные вещества — в большинстве случаев еще не лекарства. Чтобы стать ими, эти вещества должны войти в состав растворов для инъекций, таблеток, сиропов, мазей, спреев, пластырей и даже жевательных резинок или конфет, содержащих также большую долю вспомогательных индифферентных веществ, наполнителей, или, как их еще называют, эксипиентов. Их добавляют для того, чтобы упростить приготовление лекарственной формы, увеличить срок ее хранения, повысить удобство использования, биодоступность или биоактивность. Примеры улучшаемых свойств — прессуемость и механическая прочность таблеток, их гигроскопичность (чувствительность к влаге воздуха), скорость растворения, адресная доставка в нужные органы или даже клетки (например, раковые), вкус, запах, цвет. Разные лекарственные формы могут содержать вещества одного и того же химического состава, но различной кристаллической структуры (полиморфные модификации) или вообще аморфные, различаться размером и формой составляющих частиц, представлять собой соли, многокомпонентные кристаллы (со-кристаллы, сольваты), механические смеси или композитные материалы.
НОВЫЕ ЭФФЕКТИВНЫЕ ИЛИ СТАРЫЕ ПРОВЕРЕННЫЕ?
Путь от «лечебной» молекулы к лекарству занимает годы и даже десятилетия. Основные затраты времени и ресурсов приходятся на доклинические и клинические испытания, в том числе проверку токсичности, подбор оптимальной и предельной доз, а также отработку производственной технологии, выбор наиболее приемлемой формы, патентование.
Очень важна всесторонняя проверка безопасности новых лекарств, изучение побочных эффектов их применения, многие из которых проявляются лишь через много лет, иногда даже в следующих поколениях. В этом отношении старые, проверенные десятилетиями, а иногда и веками, лекарственные вещества обладают рядом преимуществ, в частности, не требуют длительных фармакологических и токсикологических испытаний, хотя их эффективность не всегда так высока, как хотелось бы. Поэтому актуальна задача разработки на их основе более действенных форм, что способно дать отдачу вложенных на исследования средств намного быстрее, чем поиск абсолютно новых препаратов.
Необходимо отметить, что огромную часть фармацевтического рынка занимают дженерики. Они содержат лекарственное вещество оригинального препарата (бренда), запатентованного какой-то фирмой, но выпускаются в виде другой формы, что позволяет выйти из поля, защищенного патентом. Поскольку аналоги намного дешевле оригинала, то их производство особенно резко возрастает после истечения срока действия патентов на бренд. Интерес к дженерикам велик не только у мелких компаний в странах с низкими доходами населения, но и у крупных транснациональных фармацевтических корпораций. Затраты на их разработку стремительно растут. Так, если в 2005 г. на эти цели в мире выделялось около 20% средств, вкладываемых в развитие лекарственных форм, то к 2015 г. предполагается ассигновать уже 50%. Для того чтобы дженерик не уступал по терапевтическому эффекту патентованному средству, надо уметь не только синтезировать субстанции или, закупая их, контролировать их химическую и стереохимическую чистоту, но и выпускать качественные лекарственные формы.
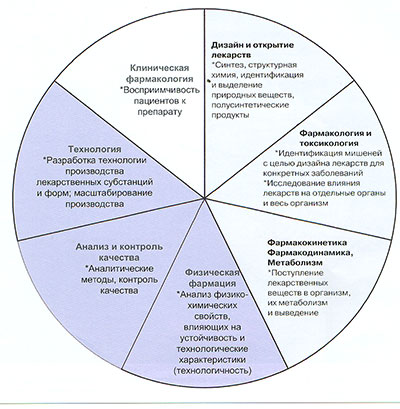
Области исследований, необходимых при разработке лекарственного препарата
Даже маленькие компании способны конкурировать с крупными, если налаживают производство дженериков. Они могут сами патентовать свои новые продукты и способы их получения, защищаясь от крупных фирм. При этом разработчики нередко изменяют состав эксипиентов, средства и пути доставки лекарственного вещества в организм, вводят в состав препарата дополнительные активные фармацевтические ингредиенты, готовят на их основе соли, смешанные кристаллы или композиты, создают новые полиморфные модификации, аморфные формы.
КОНФЛИКТ РАСТВОРИМОСТИ И ПРОНИЦАЕМОСТИ
Независимо от того, является ли лекарственное вещество абсолютно новым или давно известным, при разработке лекарственных форм (будь то бренд или дженерик) приходится решать один и тот же комплекс проблем: солюбилизации (коллоидного растворения), проницаемости биологических барьеров (трансдермального, гематоэнцефалического (Тематоэнцефалический барьер регулирует транспорт из крови в мозг биологически активных веществ, метаболитов, препятствуя проникновению в центральную нервную систему переносимых кровью чужеродных веществ, микроорганизмов, токсинов и т.д. (прим. ред.)), адресной доставки, контролирования скорости поступления в организм и выведения продуктов распада, снижения токсичности, поиска способов введения. Отдельный блок касается производства, транспортировки, хранения фармацевтических препаратов. Наконец, важно создание своей или преодоление чужой патентной защиты. Большая часть этих задач требует изменения не химического состава лекарственного вещества, а его состояния — приготовление в виде частиц определенного размера и формы, с другой кристаллической структурой или аморфного, в виде комплексов или механических смесей с другими компонентами. Все перечисленные задачи и призвана решать физическая фармация.
По имеющимся данным не менее 40% лекарственных веществ, продающихся на рынке, плохо растворимы в биологических жидкостях. А из всего количества новых веществ, предлагаемых для применения в качестве лекарств, таких намного больше — около 90%. Проблема усугубляется тем, что растворимость и проницаемость нередко находятся в конфликте, т.е. вещества, легко проходящие сквозь клеточные мембраны, что важно для их действия, как правило, плохо растворимы. К сожалению, хорошая растворимость и при этом хорошая проницаемость очень редки. Плохо растворимые и плохо проницаемые вещества бесперспективны как лекарства. Вовремя выявить такие среди новых синтезированных препаратов крайне важно для того, чтобы сохранить время и средства разработчиков.
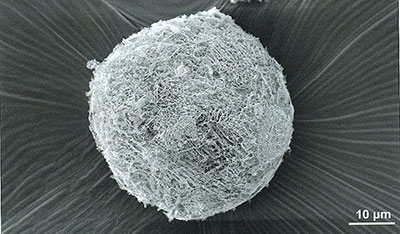
Такие микронные шарики (диаметр 20 мк) состоят из наночастиц композита лекарственного вещества. Фото А. Огиенко
Существует много способов влияния на свойства лекарственных форм (без изменения химического состава): варьирование размера частиц, их формы, изменение способа организации в ансамбль, варьирование структуры, приготовление солей, сольватов, молекулярных комплексов, со-кристаллов и др.
При изменении размера частиц от миллиметров до нанометров растворимость может увеличиваться в несколько раз. При этом важно помнить, что с точки зрения фармации такой рост лучше, чем в сотни раз. Слишком большие пересыщения, сохраняющиеся не очень долго, могут вызвать осаждение кристаллов лекарственных веществ в почках, печени, мышцах, а слишком высокая концентрация в биологических жидкостях (крови, лимфе, желудочном соке) может превысить порог токсичности. Повышение растворимости за счет образования комплексов приведет не к повышению, а уменьшению биодоступности препарата, если комплекс окажется настолько прочным, что не будет разрушаться в организме, — лекарственное вещество выйдет из него, не будучи усвоенным.
МАЛ ЗОЛОТНИК ДА ДОРОГ
Мелкие частицы не только лучше растворяются. Они нередко обладают более высокой антибактериальной активностью в отношении патогенных микроорганизмов. Для того чтобы наночастицы не слипались вместе и не теряли своих уникальных свойств, они должны быть введены в какую-то матрицу или нанесены на носитель (фторополимер, силикагель). Нередко получение таких частиц и распределение их в инертной стабилизирующей матрице производят в одном и том же процессе. Например, в нашей группе разработан метод, позволяющий в ходе твердофазных реакций получать микрошарики из наночастиц лекарственного вещества, нанесенных на носитель из одного или более компонентов. Использование двух- и более компонентных носителей позволяет «примирить непримиримое» — получить порошки веществ, хорошо растворимых в биологических жидкостях и одновременно способных проникать через биологические мембраны, что важно, например, для противораковых препаратов. Помимо этого, полученные дисперсные образцы могут гораздо лучше прессоваться в таблетки, даже без вспомогательных веществ — крахмала, целлюлозы, талька, а также использоваться в качестве порошков для вдыхания, не требуя применения фреонов. Сам носитель при этом не только не вреден, но и, напротив, дополнительно полезен, как, например, в композициях сальбутамола (препарат, купирующий приступы бронхиальной астмы) с глицином.
При использовании дисперсных частиц лекарственных веществ для введения через нос важно получать фракции строго определенного размера. Именно в зависимости от размера вдыхаемые частицы попадают в носоглотку, в центральные или периферические дыхательные пути, бронхи, легкие, а также в мозг. Кстати, одни наночастицы (например, глицина) могут успешно блокировать попадание в мозг других (например, неорганических соединений металлов) при вдыхании, что имеет значение уже для обеспечения безопасности тех, кто вынужден контактировать с наночастицами, находящимися в воздухе.
Еще одна возможность, открывающаяся за счет уменьшения размера частиц, — повышение их устойчивости в отношении структурных превращений, например, при транспортировке или хранении. Так, аминокислота DL-цистеин претерпевает фазовый переход при понижении температуры до -15°С (вполне реальные зимние температуры для России и ряда других стран), если частицы имеют размер более 10 мкм, но становится устойчивой при их размере от 1 до 10 мкм.
Существуют различные способы получения частиц контролируемого размера и формы: очень быстрая кристаллизация из раствора, механическая или ультразвуковая обработка, дегидратация или десольвата-ция более крупных частиц, полиморфные превращения в более крупных частицах, в результате которых образец разрушается на мелкие фрагменты, и, наконец, твердофазные реакции, например разложения или обмена, сопровождающиеся диспергированием образцов.
Один из перспективных методов — резкое замораживание растворов лекарственных веществ в смешанных водно-органических растворителях и последующая вакуумная сушка. При замораживании раствора образуются твердые клатраты — соединения включения молекул органического растворителя и воды, такие «смешанные льды». Лекарственное вещество при этом «выдавливается» за пределы клатрата, образуя шарики, состоящие из мельчайших частиц. Если подобрать условия сушки таким образом, чтобы клатрат испарялся, не образуя промежуточных жидких фаз, мелкие частицы лекарственного вещества удается сохранить и в дальнейшем использовать. В противном случае они перекристаллизовываются из появившейся жидкости и укрупняются, а их потребительские свойства заметно ухудшаются.
ВАЖНЫ И ФОРМА, И СТРУКТУРА
Размер частиц — не единственный параметр, влияющий на их свойства. Еще одна важная характеристика — форма (иголки, пластинки, объемные частицы с различным соотношением разных граней). Она влияет на технологические процессы (фильтрацию, таблетирование), а также на проникновение в мозг через дыхательные пути, растворение, проникновение через биологические мембраны. Например, иголки способны пройти через каналы, которые непреодолимы для пластинок. Возможно также изменение гигроскопичности и даже химической стабильности, так как удельная доля поверхностей граней, с которых начинается разложение или взаимодействие с газами в окружающей среде, изменяется. Свойства разных граней многих молекулярных кристаллов различаются настолько, что, например, одна смачивается водой, а другая нет, одна окисляется, а другая остается инертной.
Форма кристаллов существенно влияет на скорость растворения ибупрофена (противовоспалительный препарат), триметоприма (бактериостатический антибиотик) и ряда других соединений. К числу основных методов изменения формы частиц относятся варьирование пересыщения раствора, скоростей охлаждения и перемешивания, кристаллизация из разных растворителей, введение в кристаллизационный раствор или расплав примесей, поверхностно-активных веществ, например мыла, использование подложек, проведение кристаллизации в порах матрицы (к примеру, в нанопористой керамике), а также измельчение.
Важнейшая характеристика твердого вещества наряду с его химическим составом — структура. Одно и то же вещество может образовывать различные кристаллические структуры (скажем, алмаз и графит). В этом случае говорят о явлении полиморфизма. Среди молекулярных кристаллов он распространен очень широко. В фармацевтической промышленности остро востребованы умение предсказывать существование всех возможных полиморфных модификаций для какого-то вещества и разработка методов надежного и воспроизводимого получения желаемых полиморфных модификаций, а также предотвращения их неконтролируемого превращения в другие формы.
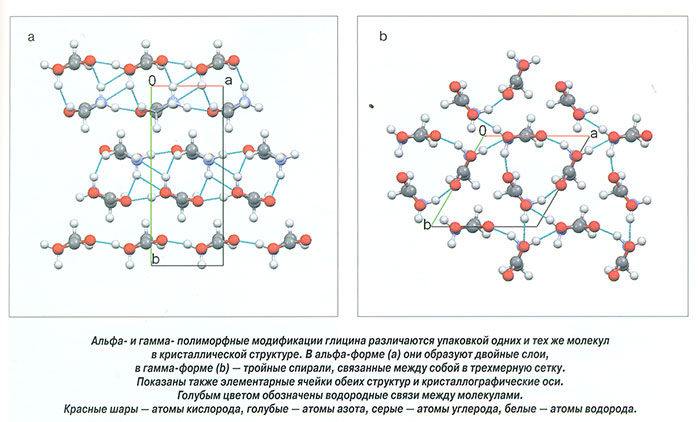
Существует много видов полиморфизма молекулярных кристаллов. Если молекулы жесткие, то кристаллические структуры могут различаться упаковкой. Примером являются модификации простейшей аминокислоты, глицина, или противовоспалительного препарата — парацетамола. Более крупные молекулы могут различаться еще и своей конформацией в кристаллических структурах, порождая конформационный полиморфизм. Примерами служат антидиабетические препараты хлорпропамид, толбутамид, многие противовоспалительные препараты, аминокислоты серии и цистеин. Наконец, полиморфизм может сопровождаться очень заметным перераспределением электронной плотности и заряда, приводя к таутомерным переходам (атом водорода переходит от одной группы к другой внутри молекулы), цвиттерионной изомеризации (молекула нейтральна в целом, но ее концы несут, соответственно, отрицательный и положительный заряды). Примеры: противовоспалительные препараты пироксикам, индометацин.
Значение полиморфизма лекарственных веществ и эксипиентов для фармацевтической промышленности невозможно переоценить. Различные полиморфы имеют разные свойства, что оказывает влияние на производство, биологическое действие, хранение и может быть использовано для улучшения лекарственных форм. С другой стороны, такие модификации могут образовываться неподконтрольно в ходе производства или при хранении, что негативно отражается на качестве и патентной защите. Не случайно проблеме полиморфизма молекулярных кристаллов вообще и лекарственных веществ в частности посвящены тысячи статей и десятки монографий.
Интересный пример того, как разные полиморфные модификации могут различаться по своей биологической активности, дает глицин. На рынке представлено множество фирм, производящих глицин, но все препараты готовятся из одной и той же полиморфной модификации — альфа-формы. Нами получено несколько патентов на способы надежного и воспроизводимого получения другой полиморфной модификации — гамма-формы — и исследована ее биологическая активность in vivo и in vitro. Было показано, что активность гамма-глицина, его влияние на электрическую активность нейронов в несколько раз выше, чем альфа-глицина.
Неконтролируемое появление полиморфных модификаций оборачивается огромными убытками из-за вынужденного снятия препарата с производства. Ярким примером может служить ритонавир — препарат для лечения ВИЧ-заболевания, выпускавшийся американской химико-фармацевтической корпорацией Abbott. Через несколько лет успешного производства вместо растворимой метастабильной формы при тех же технологических условиях начала образовываться стабильная и неактивная кристаллическая модификация. Решить проблему фирма не смогла, так как действовала неграмотно: вместо того, чтобы локализовать проблему и отрезать «инфицированный» цех от любых контактов с внешним миром, проводились многочисленные инспекции и совещания по всему миру. В конце концов затравки нежелательной более устойчивой формы оказались занесенными повсюду, и образование менее стабильной формы в их присутствии стало невозможным. Вынужденная остановка производства и замена препарата на другую форму заняла длительное время и обернулась для компании убытком в размере 500 млн долларов США.
После этой нашумевшей истории были введены новые правила аттестации лекарственных веществ: для каждого должна быть в обязательном порядке указана информация обо всех имеющихся полиморфных модификациях и сольватах. Это делает очень востребованными исследования по поиску полиморфных модификаций, расшифровке их структуры, изучению термической устойчивости, а также возможных превращений при хранении и на этапах технологической цепочки.
ПОЛИМОРФИЗМ И МЕХАНИЧЕСКИЕ ВОЗДЕЙСТВИЯ
Новые полиморфные модификации получают различными способами: за счет варьирования условий кристаллизации или хранения, температуры и давления, твердофазных превращений — фазовых переходов и химических реакций, а также в результате механического воздействия.
В процессе производства твердые лекарственные вещества неоднократно подвергаются сдвиговым и ударным воздействиям, а также одноосному или даже гидростатическому сжатию. Во многих кристаллах полиморфные переходы могут быть инициированы просто их уколом, а также при механической обработке в мельнице. Новые формы метастабильны при нормальных условиях и часто лучше растворимы, однако не могут сохраняться длительное время, если брать собственно лекарственные вещества. В присутствии эксипиентов полиморфные переходы при механическом воздействии протекают более полно, а метастабильные формы «живут» дольше — год и более, так что могут быть использованы в составе лекарственных препаратов.
Нередко для достижения желаемого эффекта необходимо сочетание нескольких воздействий. Например, механическая обработка при комнатной температуре некоторых антидиабетических препаратов не приводит к сколько-нибудь существенным изменениям. Их охлаждение и затем снова нагрев до комнатной температуры также не дают заметного результата. Однако если те же образцы охлаждать в момент механического воздействия на них, наблюдаются полиморфные превращения. При охлаждении происходит изменение конформации молекул, которое обратимо в отсутствии механического воздействия, но может привести к смене упаковки молекул в кристалле, если охлаждение сопровождается обработкой в мельнице. Иногда, напротив, превращение требует сочетания механической обработки с нагреванием. Разные виды механического воздействия — удар, сдвиг, сжатие, растяжение — могут приводить к разным результатам. Например, удар вызывает одно превращение, сдвиг — совершенно иное. Поэтому для разных превращений приходится подбирать, а иногда и специально конструировать свои аппараты.
В числе сравнительно новых приемов механического воздействия на лекарственные вещества — использование гидростатического высокого давления. Впервые оно было использовано в конце 1990-х годов для того, чтобы получить новые полиморфные модификации парацетамола. Одна из них, менее активная и не прессуемая без вспомогательных веществ, при повышении давления превращается в более активную и легко прессующуюся форму. А вот при обработке в мельнице или ручном растирании в ступке наблюдается обратный процесс.
Вызываемое давлением превращение парацетамола в новую форму в твердой фазе идет неполно, несмотря на то, что оно отвечает требованиям термодинамики. Из-за того, что все молекулы в кристалле «обычной» формы связаны сетками водородных связей в двумерные слои, их реорганизация, необходимая для перестройки структуры в более активную форму, очень затруднена. Если же приготовить раствор того же препарата и затем вырастить из него кристаллы при высоком давлении, образуется более активная форма, сохраняющаяся и при разгрузке образца до нормального давления, хотя уже как метастабильная для нормальных условий. Таким же методом удается получать и «закаливать» до нормальных условий кристаллы многих других лекарственных веществ, включая антибиотики. Воспроизводимое получение при высоких давлениях даже небольших количеств полиморфных модификаций, которые при нормальных условиях метастабильны, позволяет использовать их как затравки уже для массовой кристаллизации.
Полиморфизм может проявиться и тогда, когда его совсем не ждут. Например, образец может превращаться необратимо или с очень большим гистерезисом (различием температур прямого и обратного перехода) в другую форму при переносе из одного здания в другое (зимой), пересылке авиапочтой, при хранении в холодильнике или морозильнике. На протекание полиморфного перехода могут влиять и размер частиц, наличие в образце остаточных включений маточного раствора, из которого он вырос. Нередко такой переход может быть спровоцирован циклическим изменением температуры — от комнатной до низкой и обратно. Вопреки расхожему мнению, не все лекарства можно и полезно хранить в холодильнике.
Если кристаллическая структура нарушается таким образом, что исчезает дальний порядок (упорядоченность во взаимном расположении атомов или молекул на неограниченно больших расстояниях), говорят об аморфизации образца. При этом размер частиц может уменьшаться или же сохраняться. Аморфизация — один из самых распространенных способов получения растворимых форм лекарственных веществ. Образованию и сохранению аморфных состояний способствует механическая обработка совместно со вспомогательными веществами. Приведем только один пример из исследований ижевских ученых. Аморфный глюконат кальция обладает совершенно уникальными свойствами в сравнении с кристаллической формой того же соединения. Будучи введенным в организм, он способен встраиваться в костную ткань, способствуя залечиванию повреждений костей и хрящей, излечению остеопороза, устранению тяжелейших повреждений.
СО-КРИСТАЛЛЫ - НОВОЕ В ФАРМАЦИИ
Новый подход к созданию улучшенных лекарственных форм — дизайн и практическое получение многокомпонентных кристаллов, смешанных кристаллов, или, как их называют в современной литературе, со-кристаллов. В них молекулы разных типов закономерно чередуются, так что общая структура описывается элементарной ячейкой, в которой строго определенные позиции заняты молекулами определенного сорта. Нередко такие структуры можно рассматривать также как нанокомпозиты, в которых нанометровые слои и цепи компонентов чередуются закономерным образом. За счет образования со-кристаллов возможно модифицировать такие практически важные свойства лекарственных форм, как растворимость и его скорость, гигроскопичность, устойчивость при хранении.
Смешанные кристаллы получают кристаллизацией из раствора, расплава, а также совместным растиранием нескольких компонентов. Так, для одного из важных, но очень плохо растворимых лекарственных препаратов — мелоксикама — проблему солюбилизации удалось успешно решить за счет разработки механохимических методов получения его со-кристаллов с дикарбоновыми кислотами и анализа корреляций их структуры со свойствами. Было показано, что введение второго компонента в кристалл позволяет разрушить центросимметричные димеры молекул мелоксикама, что облегчает атаку на него со стороны молекул растворителя и тем самым облегчает переход молекул лекарственного вещества в раствор. В результате достигаются значительно более высокие концентрации мелоксикама в его растворах, причем это пересыщение сохраняется длительное время (сутки и более), что достаточно для терапии.
СИНТЕЗИРОВАТЬ ИЛИ ИСПОЛЬЗОВАТЬ «НАТУРАЛЬНОЕ»?
Очень часто мы слышим в рекламе: «Никакой химии, все натуральное!». На самом деле, сама по себе «химия», т.е. искусственно синтезированные вещества, ничем не страшнее, чем те же компоненты, извлеченные из природных материалов. Почему же иногда на самом деле лекарства природного происхождения оказываются более действенными? Причина в том, что препараты, приготовленные из природного сырья, обычно содержат не одно вещество, а много, причем в виде не механической смеси, а сложных многокомпонентных структур — композитов. Еще наши далекие предки знали, что для применения лекарственных растений вовсе не обязательно извлекать из них чистые вещества. Напротив, гораздо действеннее использовать растение целиком, правда, подвергнув его предварительной обработке, например механической (истолочь в ступке или растереть между камнями).
Пройдя через этап «увлечения химией», т.е. извлечения лекарственных веществ из природных материалов при помощи различных растворителей, человек возвращается к истокам. Сначала многостадийная экстракция, требовавшая расходования тонн дорогостоящих и токсичных органических растворителей и воды, была заменена на значительно менее вредную для окружающей среды и более экономичную «сухую» с помощью механохимических технологий, а затем от экстракции отдельных веществ отказались вовсе. Удалось подобрать такие условия механической обработки, при которой клеточные мембраны растительной ткани разрушаются, делая активные вещества биодоступными, а сами лекарственные компоненты при этом сохраняются. Остающиеся в таком «активном» образце растительные полимерные волокна и другие соединения не только не мешают действию лекарственных веществ, напротив, улучшают характеристики препарата, играя ту же роль, что и синтетические эксипиенты в таблетках. Только в данном случае их не надо вводить в таблетку извне: они уже содержатся в приготовленном из природного материала механокомпозите. За данным методом — будущее. Он связывает опыт народной медицины с самыми современными медицинскими технологиями и при этом позволяет рационально использовать природные ресурсы. Нередко в производстве ценнейших лекарственных препаратов, в том числе противоопухолевых, иммуномодулирующих и многих других, используются части растений, остающиеся в виде тонн отходов в результате хозяйственной деятельности человека — кора и опилки лиственницы, березы, кедра, рисовая шелуха и т.п. В Юго-Восточной Азии предложенные «сухие» механо-биотехнологии вызвали огромный интерес, не в последнюю очередь потому, что позволили избавиться от большой массы отходов.
В заключение подчеркну, что «рецептурные способы» получения фармпрепаратов себя изжили. Получить качественную лекарственную форму можно, лишь опираясь на достижения фундаментальных исследований. Дизайн, скрининг, оптимизация лекарственных форм не менее важны, чем скрининг и синтез лекарственных субстанций. Работы в этом направлении ведутся во всем мире, и наш научно-образовательный центр «Молекулярный дизайн и экологически-безопасные технологии» Новосибирского государственного университета занимает в этой области достойное место. Свидетельство тому — приезжающие к нам учиться и работать магистранты, аспиранты и профессора из многих стран мира, включая Великобританию, Италию, Австрию, США, Швейцарию, Германию, Канаду.
Доктор химических наук Елена БОЛДЫРЕВА,
заведующая кафедрой химии твердого тела
Новосибирского государственного университета,
руководитель группы реакционной способности твердых веществ
Института химии твердого тела и механохимии СО РАН
«Наука в России» . – 2014 . - № 3 . – С.26-35.






 Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий
Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий





